¿QUE SON LOS ESTERES?
Se forman por reacción entre un ácido y un alcohol
• Pueden provenir de ácidos alifáticos o aromáticos
• Se nombran como sales, reemplazando la terminación de los ácidos por oato seguido del nombre del radical del alcohol .
• Son compuestos orgánicos derivados de ácidos orgánicos o inorgánicos oxigenados
• Los ésteres más comunes el ácido en cuestión es un ácido carboxílico.
Las moléculas de éstercontienen un grupo carbonilounido a un grupo -OR. Esconveniente considerar un ésteren términos de un ácido y unalcohol precursores que podríanreaccionar para producir eseéster. La parte ácida de un ésterincluye el grupo carbonilo y unátomo de hidrógeno, un grupoalquilo o un grupo arilo. La partealcohólica de un éster incluye elgrupo -OR.


Las moléculas de éstercontienen un grupo carbonilounido a un grupo -OR. Esconveniente considerar un ésteren términos de un ácido y unalcohol precursores que podríanreaccionar para producir eseéster. La parte ácida de un ésterincluye el grupo carbonilo y unátomo de hidrógeno, un grupoalquilo o un grupo arilo. La partealcohólica de un éster incluye elgrupo -OR.


NOMENGLATURA
Los ésteres proceden de condensar ácidos con alcoholes y se nombran como sales del ácido del que provienen. La nomenclatura IUPAC cambia la terminación -oico del ácido por -oato, terminando con el nombre del grupo alquilo unido al oxígeno.
ETANOATO DE METILO


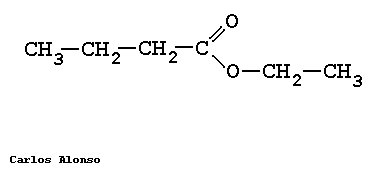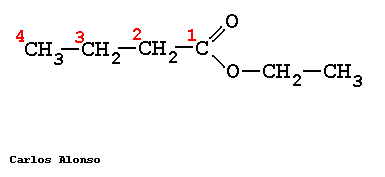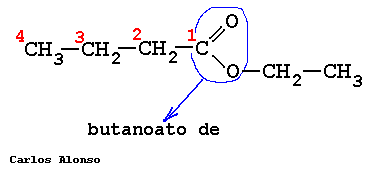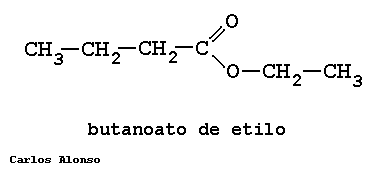
PROPANOATO DE METILO
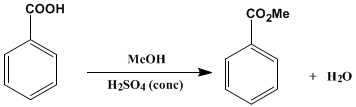
Preparación del benzoato de metilo
Los ésteres de ácidos carboxílicos se pueden formar por reacción entre un ácido carboxílico y un alcohol en presencia de un catalizador ácido protónico tal como el cloruro de hidrógeno, ácido sulfúrico o un catalizador ácido de Lewis tal como el trifloruro de boro (usualmente formando un complejo con el éter dietílico). También puede prepararse por reacción de un haluro de alcanoilo o anhídrido con un alcohol.
Reacción de la síntesis
Instrumentación
Equipo para destilación a presión atmosférica.
Reactivos
Ácido benzoico 12.2 g
Metanol absoluto 20 ml (inflamable, tóxico)
Ácido sulfúrico concentrado 2 ml (corrosivo, oxidante)
Éter dietílico (irritante, inflamable)
Disolución de hidróxido sódico (5%) 30 ml (corrosivo)
Procedimiento experimental
En un matraz de 100 ml se introducen 12.2 g de ácido benzoico, 20 ml de metanol absoluto y 2 ml de ácido sulfúrico concentrado. Se añaden unos trocitos de plato poroso, se adapta un refrigerante y la solución se hierve a reflujo durante 50 minutos. Pasado ese tiempo, la solución se enfría, se vierte sobre 75 ml de agua bien fría y se extrae con 50 ml de éter dietílico (benzoato de metilo, d=1.09 g/ml). La fase orgánica obtenida se lava, primero, con 30 ml de solución de hidróxido sódico al 5% y, después, con 30 ml de agua. A continuación, se seca sobre sulfato sódico anhidro, se filtra y se evapora a presión reducida. El crudo resultante se destila a presión reducida.
Benzoato de sodio
El benzoato de sodio, también conocido como benzoato de sosa o (E211), es una sal del ácido benzoico, blanca, cristalina y gelatinosa o granulada, de fórmula C6H5COONa. Es soluble en agua y ligeramente soluble en alcohol. La sal es antiséptica y se usa generalmente para conservar los alimentos.
C6H5-COOH + NaOH <-> NaC6H5CO2 + H2O
Origen del benzoato de sodio
El ácido benzoico, los benzoatos y los ésteres del ácido benzoico son compuestos comúnmente encontrados en la mayoría de las frutas, especialmente en las bayas; siendo los arándanos una fuente abundante del mismo. Adicionalmente, los benzoatos se encuentran de manera natural en las setas o champiñones, la canela, el clavo de olor y en algunos productos lácteos (debido a la fermentación bacteriana). Con fines comerciales, estos compuestos son preparados químicamente a partir del tolueno.
| Benzoato sódico | |
|---|---|
 | |
| Nomenclatura IUPAC | Benzoato Sódico |
| Otros nombres | E211, benzoato de sosa |
| Fórmula semidesarrollada | NaC6H5CO2 |
| Masa molecular | 144,1053 g mol−1 |
| Número CAS | [532-32-1] |
| Densidad | 1,44 g cm−3 |
| Punto de fusión | 410 °C (770 °F; 683 K) |
| Punto de ebullición | N/A |
| SMILES | O=C([O-])C1=CC=CC=C1.[Na+ |
Usos del benzoato de sodio
Por ser un conservante bactericida y funguicida, es comúnmente utilizado en: bebidas carbónicas, ensaladas de fruta, jugos, mermeladas, jaleas, caviar, margarinas, caramelos, pasteles de fruta, salsas etc.
LAS AMIDAS
¿Qué Son?
Una amida es un compuesto orgánico que consiste en una amina unida a un grupo aciloconvirtiéndose en una amina ácida (o amida). Por esto su grupo funcional es del tipo RCONR'R'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R' y R'' radicales orgánicos o átomos de hidrógeno:
Se puede considerar como un derivado de un ácido carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRR' (llamado grupo amino).
Formalmente también se pueden considerar derivados del amoníaco, de una amina primaria o de una amina secundaria por sustitución de un hidrógeno por un radical ácido, dando lugar a una amida primaria, secundaria o terciaria, respectivamente. Concretamente se pueden sintetizar a partir de un ácido carboxílico y una amina:
OBTENCIÓN DE HIDRÓGENO
- OBJETIVO: ES OBTENER LA SUSTANCIA QUÍMICA DE HIDRÓGENO PARA PODER DESTILAR ESTE PROCEDIMIENTO, NECESITAREMOS DE LOS SIGUIENTES MATERIALES..
MATERIALES
*TUBO DE ENSAYO
*SOPORTE UNIVERSAL
*MATRAZ DE DESTILACIÓN
*VASO PRECIPITADO
*TRIANGULO DE ADVESTO
*MANGUERA
*NUEZ
*EL MECHERO GUNSE
*BARILLO UNIVERSAL
*BRAZO DE SOLUCIÓN
*EL ARO
*EL ELESRMEYER
*EL CERVENTIL
*BALÓN
PROCEDIMIENTO
- colocamos el mechero y el soporte para el matraz
- añadimos agua y cinc al matraz y lo ponemos a calentar
- añadimos agua y cinc estén hirviendo, el hidrógeno se va por la manguera hacia el vaso precipitado
- como el vaso precipitado está con agua el hidrógeno se va a la parte de abajo
- cuando el hidrogeno este allí metemos el tubo de ensayo de para abajo, esperamos un momento, lo tapamos con el dedo y lo sacamos
- para verificar si la obtención de hidrógeno fue exitosa ponemos el tubo d ensayo de para abajo sin apuntar a nadie, le ponemos el mechero y si hace una pequeña explosión la obtención de hidrógeno fue exitosa..
CONCLUSIÓN
CADA UNO DE ESTOS ELEMENTOS EN EL LABORATORIO SON NECESARIOS PARA LA OBTENCIÓN DEL HIDRÓGENO
EL HIDRÓGENO NO SE PUEDE OBTENER SI EL AGUA NO TIENE ZINC.
MONTAJE DE DESTILACIÓN

OBTENCION DEL ALCOHOL ETANOL
-OBJETIVO: Es que el alcohol etanol obtenido por el jugo de naranja, es importante también en diferentes procesos de catalizacion, fue de obtener un importante químico llamado zinc..
MATERIALES
-TERMÓMETRO
-BALÓN
-MANGUERA
-CERVENTIL
-SOPORTE UNIVERSAL
-VASO PRECIPITADO
-MECHERO
-EL ELERSMEYER
PROCEDIMIENTO
1. Armar el equipo de destilación.
2. Colocar la sustancia fermentada en el matraz de destilación.
3. Encender el mechero y colocarlo debajo del matraz.
4. Abrir el paso de agua al refrigerante.
5. Esperar hasta que la sustancia complete el proceso de destilación.
6. Comprobar que la sustancia obtenida sea alcohol etílico.
1. Extraer el jugo de la naranja y colocarlo en un recipiente.
2. Disolver, en otro recipiente, una cucharadita de levadura en agua tibia.
3. Mezclar las dos sustancias, y sellar el recipiente.
4. Colocar el airlock, y dejar fermentar hasta que se libere todo el dióxido de carbono.
2. Colocar la sustancia fermentada en el matraz de destilación.
3. Encender el mechero y colocarlo debajo del matraz.
4. Abrir el paso de agua al refrigerante.
5. Esperar hasta que la sustancia complete el proceso de destilación.
6. Comprobar que la sustancia obtenida sea alcohol etílico.
1. Extraer el jugo de la naranja y colocarlo en un recipiente.
2. Disolver, en otro recipiente, una cucharadita de levadura en agua tibia.
3. Mezclar las dos sustancias, y sellar el recipiente.
4. Colocar el airlock, y dejar fermentar hasta que se libere todo el dióxido de carbono.
CONCLUSION
se puede obtener alcohol etílico por un método muy sencillo a partir de cualquier sustancia que contenga glucosa, sacarosa o fructosa gracias a la acción de las enzimas producidas por la levadura. Se puede observar también el desalojamiento del gas CO2 en el recipiente con agua durante el proceso de fermentación..
MONTAJE DE DESTILACIÓN

EQUILIBRIO QUIMICO Y VELOCIDAD DE REACCION
en quimica el concepto de equilibrio quimico, debe definirse con precision, el equilibrio quimico estudia los factores que determinan una reaccion que dirige hacia la derecha.
los factores que afectan el equilibrio quimico se puede desplazar combinando las concentracciones, la precision volumen o la temperatura, los efectos de las fuerzas que tienden a romper el equilibrio,
efecto del cambio de concentraccion; es un sistema de equilibrio a precision y temperatura constante.
por ejemplo; en la reaccion NA (g) + 3 H2 (g) -
cambio de precision: cuando una reaccion se afecta en estado gaseoso a temperatura y volumen constante y la precision es el factor mas importante que influye en el equilibrio.
cambio del volumen de recipiente: cuando el volumen del recipiente donde ocurre la reaccion y varia tambien las competencias de las reaccionantes.
variacion de la temperatura: si se aumenta la temperatura, el sistema reacciona en el sentido de gastar el color añadido.
adiccion de catalizadores: los catalizadores no afectan el equilibrio de un sistema, pues aceleran de la misma manera de velocidad de reaccion, estos procesos tambien son reacciones reversibles.
VELOCIDAD DE LAS REACCIONES QUIMICAS
una caracteristica importante que tienen las reacciones quimica, es su velocidad de reaccion a la rapidez con la cual se alcanza el estado de equilibrio, la cinetica quimica estudia las velocidades quimicas.
VELOCIDAD DE REACCION= CAMBIO DE CONCENTRACIÓN
TIEMPO
por tanto la velocidadde reaccion se expresa en mol.
N2 + 2H2-2NH3
la concentracion del nitrogeno disminuye el tiempo (luego su derivado sera negativa),pero por la caida del mol N2 se consumen 3 de H2 y la velocidad de desaparicion.
V= d(N2) = 1 = d(N2) = 1 = d(NH3)
d+ 3 2 d+
en general se suele estudiar la velocidad inicial de la reaccion directa, para ella se escribe una reaccion en la forma general.
FACTORES QUE INFLUYEN EN LA VELOCIDAD DE REACCION
existen varios factores que influyen en la velocidad de una reaccion: la concentracion de las reacciones, la temperatura, la catalisis de los reaccionantes.
¿COMO INLUYE LA CONCENTRACION EN LA VELOCIDAD DE REACCION?
diferentes reacciones quimicas que proceden a velocidades diferentes.
¿COMO INFLUYE LA TEMPERATURA SOBRE LA VELOCIDAD DE REACCION?
esto ocurre, por que las moleculas adquieren mayor energia cinetica por la cual hay mayor probabilidad de choques entre ellos.
este efecto se observa en la reaccion de un velon con el aire, al acercar una serilla se enciende el pabilo de la vela por que aumenta la temperatura.
ACCION DE LOS CATALIZADORES EN LA VELOCIDAD DE REACCION
muchas reacciones por muy lentas que sean, cuando se mezclan solo los reactivos, pero es posible lograr que se produzcan mas tradiciones.
¿ACCION DE LA NATURALEZA DE LOS REACCIONANTES EN LA VELOCIDAD DE REACCION?
la naturaleza de los reaccionantes puede ser fisica o quimica.
la naturaleza quimica tiene que ver con el calentamiento de los atomos con la fuerza de enlaces.
COMPETENCIA PARA INTERPRETAR
RESPUESTAS
1.A.) disolver una tableta efervecente?
aconsejar agua fria ya que esta hace una reaccion quimica con el agua un experimento casero para completarlo
B.) los factores son una mala fusion entre los 2 elemenos, las 2 flechados, si sucede al primer efecto.
C.) se aumenta la presion en un sistema de equilibrio que disminuye.
D.) la velocidad que ejerce una sustancia en reaccionar a sus componentes.
E.) tiene que ver con los atomos, con la fuerza y el numero de los enlaces
F.) azufre doududo de carbono
G.) s A+B cambian pueden influir (+d), si se dice que puede suceder una reaccion en cadena.
I.) los catalizadores ayudan a controlar los componentes quimicos.
2.B.) la velocidad media de reaccion no es constante.
3.C.) la reaccion de combustion de forzado con la cabela de tivaccion elevado.
4.D.) alterar la velocidad del, con las sustracciones cuya reaccion catalizan.
5.D.) la velocidad de reaccion directa son nucleos
6. A) - concentracion - 2
B)- concentracion - 3
C) - concentracion - 5
D) - concentracion - 1
7.) B
8.) C
9.)D
BIBLIOGRAFIAS
http://esteresmania.blogspot.com.co/2010/08/definicion.html
WIKIPEDIA-
https://es.wikipedia.org/wiki/Benzoato_de_sodio
31-Ene-2007 QuimiNet
31-Ene-2007 QuimiNet
http://www.quiminet.com/articulos/el-benzoato-de-sodio-18270.htm
http://quimicaorganicacmi2012.blogspot.com.co/2012/10/amidas.html
Enviado por Yasser Alvarez
http://www.monografias.com/trabajos94/alcohol-etilico/alcohol-etilico.shtml
ULISES ARÉVALO BELLO 29 de julio de 2016, 19:45
http://cienciasenbachillerato.blogspot.com.co/2011/05/velocidad-de-reaccion-y-equilibrio.html
Miguel Vaquero - 2014
Miguel Vaquero - 2014
http://www.deciencias.net/simulaciones/quimica/reacciones/concentra.htm
Raquel Enríquez García -
- Chang R., Química, 7ma. Ed., Ed. Mc Graw Hill, México, 2003
http://prepa8.unam.mx/academia/colegios/quimica/infocab/unidad215.html
YAHOO! 2016
https://es.answers.yahoo.com/question/index?qid=20110509083458AAGMeLR
Publicada en el año 2013. por polemicus
http://polemicus.com/preguntas/44/quimica-como-influye-la-temperatura-sobre-la-velocidad-de-una-reaccion


No hay comentarios:
Publicar un comentario